
胎盘干细胞简介
胎盘(Placenta)是母体与胎儿间物质交换的器官,也是重要的造血和免疫组织。胎盘由羊膜(Amnion)、绒毛膜(Chorion)和底蜕膜(Decidua)等构成,通过脐带(umbilical cord)连接母体(图1)。胎盘组织由滋养细胞及间充质和血管共同组成,为免疫“豁免”组织。
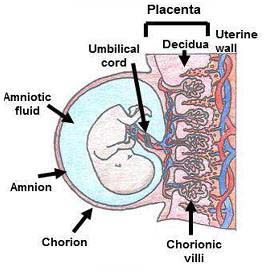
图1. 人类胎盘示意图
胎盘干细胞指的是存在于胎盘组织中的干细胞。近十年内,胎盘干细胞产业化技术的出现和临床应用的不断推进,国际上关于胎盘干细胞的研究成果呈现了井喷之势(如图1所示)。2008年,M. Evangelista等在国际学术杂志《Cytotechnology》上发表论著,阐述了胎盘干细胞是未来细胞治疗的新希望这一事实。随后的几年里,针对胎盘干细胞的研究如雨后春笋般出现。2012年,美国奥克兰研究所儿童医院(CHORI)的研究者在国际杂志《Stem Cells Translational Medicine》杂志刊登了最新成果,系统阐述了胎盘干细胞具有的高度治疗应用价值。
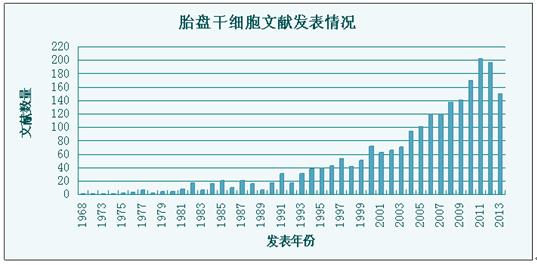
图2. 国际上胎盘干细胞文献发表情况(截至2013年7月底)。
干细胞新技术为未来医疗应用带来了新希望,但目前社会上公众甚至医务人员对胎盘干细胞这个概念了解不够,常将胎盘中不同的干细胞理解为一种干细胞或以为是一堆不能分开的混合细胞,或者将胎盘干细胞与脐带血干细胞混为一谈。在这里编者向大家详细地介绍一下胎盘干细胞。
胎盘干细胞种类
目前已知证明的胎盘干细胞包括造血干细胞、血管干细胞、间充质干细胞、亚全能干细胞、皮肤干细胞、神经干细胞等多种干细胞。
1、 胎盘造血干细胞
胎盘具有造血功能的观点早已有之,1967年即有报道小鼠胎盘中含有造血前体细胞1。1987年科学家发现胎盘绒毛膜存在基质和血管前体细胞2,1989年又在胎盘绒毛膜鉴别出分化成血液细胞和血管细胞的血液血管干细胞3。大量的研究表明胎盘是一个自主的造血干细胞的起源,从胚胎形成后3周开始造血,具有和AGM,卵黄囊一样的造血功能。胎盘组织造血微环境包括造血因子的表达,血管内皮的类型,血流切力影响,表面分子的改变,血氧浓度等等4 (图3)。
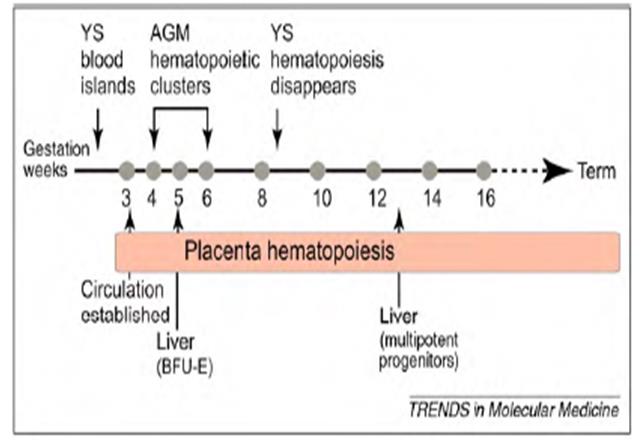
图3. 胎盘是一个造血组织(Trends Mol Med, 16(8):361-7, 2010)
对胎盘造血干细胞的研究不但能了解造血干细胞的发育过程与调控机制,而且可以提供了新的造血干细胞移植细胞来源。因此近10多年,国内外学者对胎盘组织来源的造血干细胞的鉴别、分离和应用进行了大量的研究。2002年-2006年期间,国内学者率先发现胎盘组织含有造血干细胞,并对其的分离、富集和生物功能进行了研究5-9。随后,国外许多著名研究机构的研究进一步明确胎盘组织造血干细胞的存在及其体内外造血功能,一致认为胎盘是临床移植用造血干细胞的一个新的来源10-17。运用流式细胞计数技术检测脐血、胎盘血、血管、胎盘(胶原酶处理后)中造血干细胞(CD34+CD38-细胞)以及造血祖细胞(CD34+CD38+细胞)的含量(图4)。结果显示,胎盘中含有1.1±0.79%的造血祖细胞,含有0.39±0.21%的造血干细胞。与之相比,脐带血含有0.31±0.05%的造血祖细胞和0.06±0.01%的造血干细胞。胎盘血中含有0.43±0.16%的造血祖细胞和0.06±0.04%的造血干细胞。同时,运用免疫荧光染色技术检测到(图5),早在16周的胎盘中就含有造血干细胞(CD34+CD45+细胞)。
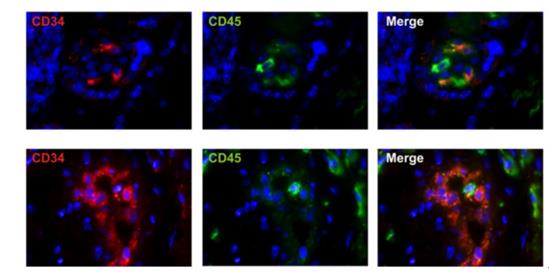
图5. 免疫荧光染色技术检测胎盘造血干细胞。
人足月胎盘可以提供大量的CD34 阳性、CD133 阳性细胞以及其他原始的造血祖先细胞,适合人类移植。目前公认CD133 阳性的造血干细胞比CD34 阳性造血干细胞更早期,由胎盘取得的造血干细胞或培养出的群落形成单元的总数量可以是同一来源脐带血可得造血干细胞的10 倍。
《Exp Biol Med》杂志编编辑部认为,这些研究结果对于血液学的应用有很大的重要性,因为脐带血分离的干细胞数量少会限制它使用的有效性,只能用在一个幼儿或少年患者的移植,这一新发现证明胎盘可以提供自体干细胞足够的数量重建成年人的造血系统。可见胎盘造血干细胞可以取代骨髓、外周血和脐血的移植,必将会深刻改变整个造血干移植治疗领域18。
正因为以上优势,目前美国、英国、加拿大等多家机构都在开发和完善胎盘造血干细胞库的建设。中国在2011年由北京汉氏联合生物技术有限公司创建了首个胎盘组织造血干细胞库。预计在不久的将来,全世界将出现多个胎盘造血干细胞库,以满足临床的实际需求。
2、胎盘亚全能干细胞
胎盘亚全能干细胞是来源于新生儿胎盘组织的一族胚胎后亚全能干细胞(Post-embryoni pluripotent stem cells),其在发育阶段与胚胎干细胞接近,具备分化形成三个胚层的组织细胞的能力,但与胚胎干细胞的不同之处是不会形成畸胎瘤,这一特性使亚全能干细胞可以直接用于体内而不必担心在体内产生畸胎瘤。
胚胎后亚全能干细胞这个名词最早于2004年由中国医学科学院血液学研究所的博士研究生房佰俊在其博士论文19中提出。论文认为,在人体胚胎发育过程中,在多种组织中存留着具有多系分化能力的原始干细胞群体,并系统阐明了成体原始干细胞的等级结构性和功能。它们在胚胎发育成熟后逐渐失去部分原始干细胞表型,但在胚胎发育为成体后仍具有亚全能基因组,其中组织特异性基因在适当的微环境下可以被激活,因各自所处的微环境不同而向不同的组织分化,能够全方位地选择分化为各种组织细胞。
亚全能干细胞作为胚胎干细胞的后代,可与其他各个成熟阶段的干细胞和祖细胞共存于组织中。如同骨髓中存在造血干细胞、髓系祖细胞、淋系祖细胞、T前体细胞和B前体细胞一样,组织中具有干细胞“等级结构”。处于等级结构上层的亚全能干细胞在胚胎发育成熟后逐渐丧失部分分化潜能,随后储存在某些组织器官中进入细胞增殖期以维持人体发育和新陈代谢的平衡。在胎盘羊膜等组织中也富含亚全能干细胞20。亚全能干细胞的鉴别标志有不同,房佰俊等采用Flk1+CD31-CD34-组合细胞表面标志来鉴别亚全能干细胞19-21。北京汉氏联合生物技术有限公司在其专利中公开了一种胎盘亚全能干细胞的制备方法,及其用于制备治疗细胞损伤或细胞衰老疾病的药物中的用途,以及其用作基因治疗药物的载体细胞的用途22。其细胞制备方法为:将胎盘组织破碎,蛋白酶降解、过筛,分离得到原代单个核细胞,使用常规的磁式细胞分选法,以CD184-CD151+/OCT4+为细胞表面组合标志来分选,从采集的单个核细胞中分选出目的细胞。分离得到的胎盘亚全能干细胞能够向成脂、成骨、成软骨、心肌、神经、肝细胞分化。
胎盘亚全能干细胞具有强大的增殖能力和多向分化潜能。在适宜的体内或体外环境下具有分化为间充质干细胞,上皮干细胞、神经干细胞、肝干细胞,肌细胞、成骨细胞、软骨细胞、基质细胞等多种细胞的能力。可以用来修复受损或病变的组织器官,治疗心、脑血管疾病、神经系统疾病、肝脏疾病、骨组织病、角膜损伤、烧伤烫伤、肌病等多种疾病。
胎盘亚全能干细胞具有来源方便,细胞数量充足,易于分离、培养、扩增和纯化,传代扩增30多代后仍具有干细胞特性。取材几乎不受限制:胎盘在胎儿娩出后就完成了使命,成为“废弃物”,只要正常分娩的健康产妇,在知情同意的基础上,都能够提供胎盘,与捐献骨髓相比,患者无痛苦,污染机会小。应用不存在伦理学问题。
3、胎盘间充质干细胞
近年来,间充质干细胞生物学的兴起为再生医学的发展及多种顽固性疾病的治疗带来新的希望。间充质干细胞(mesenchymal stem cells, MSC)作为多能干细胞之一,不仅具有干细胞的共性即无限增殖能力和多向分化潜能,还具有以下优势:1)、具有低免疫原性以及免疫抑制作用,这就使得治疗用的MSC不仅可以来源于自体,也可以来源于异体;2)、具有强大的免疫调节作用,使得移植的MSC在修复受损组织的同时,还可以调节患者的免疫状态;3)、具有向特定细胞定向分化的特性,避免了胚胎干细胞等全能干细胞致瘤性风险;4)、来源非常广泛,骨髓、胎盘脐带为富含MSC的部位,此外在脂肪、脐带血以及其他成体组织器官中也能分离到MSC。
胎盘含有现在称为间充质干细胞样的基质细胞最早发现于197723。随后,大量的研究发现,胎盘的各个部位,如脐带、羊膜、绒毛膜、以及底蜕膜均含有间充质干细胞24-30,包括婴儿的以及母亲自己的间充质干细胞。不同组织来源的间充质干细胞有共同的特征31,但也存在一些不同之处,因此,临床上使用应根据其不同特点选择最合适的来源32-36。
国际上胎盘干细胞的临床研究
胎盘干细胞技术是继骨髓、外周血和脐带血来源的干细胞技术后的最新的非胚胎干细胞技术,从推出伊始,就受到了国际上无数专家学者的关注。目前已经在临床上广泛开展应用研究。目前国际上已经有很多胎盘来源干细胞的临床研究,在美国国立卫生研究院的最大临床试验注册库ClinicalTrials.gov网站上,胎盘干细胞的临床实验已有22项,主要集中在北美,其中中国境内有四项(图6)。治疗相关的疾病包括:重型再生障碍性贫血、骨髓增生异常综合征、白血病等恶性或非恶性血液疾病,还有二型糖尿病、特发性肺纤维化、强直性脊柱炎、溃疡性结肠炎等非血液系统疾病。
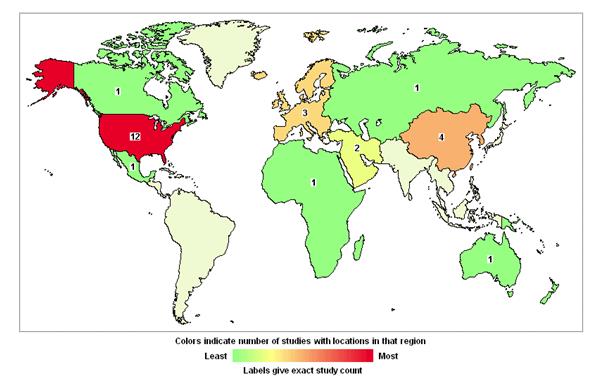
图6. 胎盘干细胞临床试验全球分布图
另外,世界上第六大生物制药企业--美国Celgene公司的胎盘干细胞治疗药物PDA-001已于2010年启动临床II期试验,评估细胞疗法对克罗恩病的作用,其目前药物研发中涉及到胎盘干细胞的药物,主要针对克罗恩病、多发性硬化症、关节炎、肉状瘤病,分别在一期临床和二期临床。Celgene公司现已控股美国胎盘自体储存企业LifebankUSA(https://www.lifebankusa.com/)。
纳斯达克的上市公司Pluristem Therapeutics (Nasdaq:PSTI)是一家一流的胎盘干细胞药物开发机构。在2008年就完成其胎盘干细胞制备的新药PLacental eXpanded (PLX)的临床前研究,准备开始人体临床实验,PLX为Pluristem治疗下肢动脉血管疾病的药物,2011年Pluristem 公司增加PLX细胞治疗辐射病的研究,2012年Pluristem公司获德国PEI批准启动PLX细胞I/II期肌肉再生试验。PLX细胞疗法目前已经治愈了三位白血病患者。日前治愈的第三位患者年龄45岁,患有急性髓性白血病,在经过了化疗和非亲缘异基因骨髓移植之后,发现具有严重并持续的血细胞减少(缺少白细胞)以及其他并发症。其生命垂危,在骨髓移植近5个月后,医生分两次向其体内注射了PLX细胞,前后间隔一周。之后,该病人身体逐渐好转,全身或者局部未出现不良反应。Pluristem公司目前正向美国食品和药物管理局(FDA)申请,将该PLX细胞疗法作为治疗再生障碍性贫血的“罕见病药物”。
最近Pluristem 公司宣布它的韩国合作公司 Cha Bio & Diostech 已经向韩国食品与药品监督管理局申请使用PLX,Cha Bio & Diostech希望获得韩国食品与药品监督管理局批准用该药物进行外周动脉疾病和间歇性跛行的II期临床试验。
胎盘干细胞:细胞治疗和再生医学的新希望
所有的技术都是不断发展的,新技术替代老技术是必然的趋势。无论是众多学者的基础研究工作,还是临床应用中的实际佐证,都证明了富含多种类珍贵干细胞资源的胎盘组织是未来细胞治疗的优秀种子细胞来源。
在干细胞种类上,胎盘干细胞覆盖并明显超越了前两代围产期组织干细胞技术——脐带血造血干细胞和脐带间充质干细胞,能够做到一份胎盘组织,提取四种干细胞:婴儿的干细胞,包括亚全能干细胞、间充质干细胞和造血干细胞,以及母亲的间充质干细胞。胎盘干细胞库技术可以为孩子和母亲为今后所需的细胞治疗和组织器官再生医学保存了年轻、组织分化增殖能力很强的种子干细胞。(图7)。
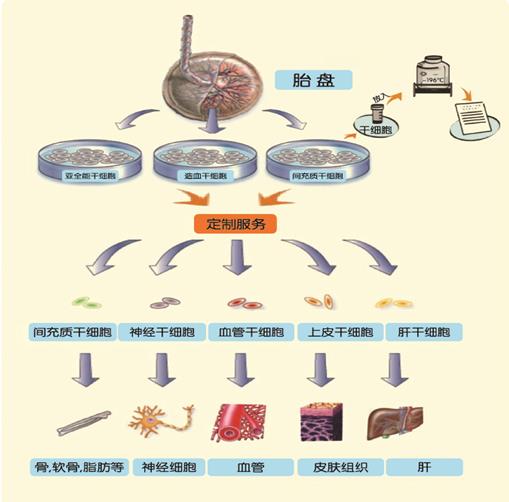
图7. 胎盘干细胞库及其应用前景
在干细胞数量上,尤其是造血干细胞数量上,实现了质的飞跃。一份胎盘造血干细胞,相当于统一供体脐带血造血干细胞的5-10倍。由于脐带血造血干细胞的数量缺陷,导致其利用率极低,目前国内储存自体脐带血已经超过30万份,但真正自体应用的聊聊无几,目前相关公司宣传的使用几百份基本上为异体配型后的应用,而非自体储存应用。脐带血造血干细胞这一不足正是其在临床上应用极少的主要原因。
技术不断向前发展,胎盘造血干细胞能很好地弥补脐带血造血干细胞的缺陷,为人们提供了更多的选择。胎盘干细胞,已成为细胞治疗和再生医学的新希望。


 鄂公网安备 42088102000026号
鄂公网安备 42088102000026号